وسائل تعليمية كيمياء chemistry وسائل تعليمية كيمياء chemistry وسائل تعليمية كيمياء chemistry
وسائل تعليمية كيمياء chemistry وسائل تعليمية كيمياء chemistry
وسائل تعليمية كيمياء chemistry

إخواني وأخواتي السلام عليكم ورحمة الله وبركاته وأهلاً وسهلاً بكم مع :
درس الرابطة التساهمية
الأهداف التعليمية
يتوقع من الطالب في نهاية الدرس أن :
1- يعرّف الرابطة التساهمية .
2- يمثّل للرابطة التساهمية .
3- يذكر بعض العناصرالتي يمكن لها الارتباط بروابط تساهمية .
4- يشرح سبب وجود المركبات التساهمية في كل الحالات الثلاث للمادة .
5- يوضح سبب عدم توصيل المركبات التساهمية للتيار الكهربي في حالتها النقية وفي مصاهير الصلبة منها .
6- يحدّد متى يكون المحلول المائي للمركب التساهمي موصلاً للكهرباء .
7- يتعرّف تركيب لويس للجزيئات التساهمية .
8- يوضح تركيب لويس لجزيء تساهمي معطى .
9- يميّز بين الزوج الالكتروني الرابط والزوج غير الرابط .
10- يعرّف القاعدة الثمانية .
11- يمثّل لجزيئات تساهمية تشد في تركيبها عن القاعدة الثمانية .
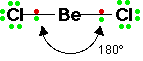
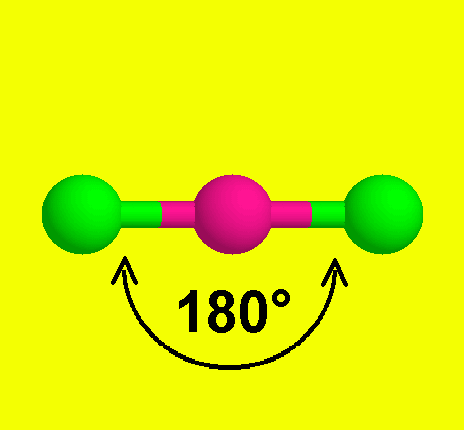
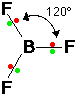
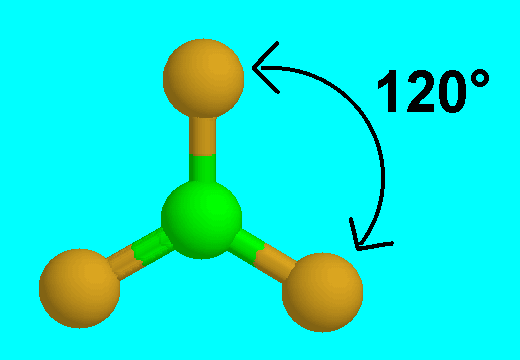
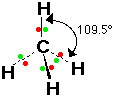
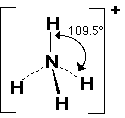
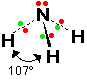
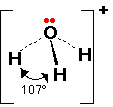
12- يوضح سبب اتخاذ الجزيئات التساهمية لأشكال هندسية في الفراغ .
13- يذكر العامل الذي يحدّد الشكل الهندسي للجزيء التساهمي .
14- يذكر سبب اختلاف الزوايا بين الروابط في الشكل الهندسي الواحد .
15- يعرّف السالبية الكهربية للعناصر .
16- يوضّح طبيعة العلاقة بين جهد التأين والألفة الالكترونية للعناصر من جهة وبين سالبيتها الكهربية .
17- يكتب قيم السالبية الكهربية للعناصر التالية : الفلور ، الأكسجين ، الكلور ، النيتروجين ، الكربون ، الهيدروجين .
18- يشرح مفهوم القطبية في الجزيئات التساهمية .
19- يحدّد متى تكون الرابطة التساهمية قطبية ومتى تكون غير قطبية .
20- يميّز بين المركبات القطبية وغير القطبية .
21- يعرّف العزم الكهربائي .
22- يعلّل سبب عدم قطبية بعض المركبات التساهمية بالرغم من اختلاف عناصرها في السالبية الكهربية ( احتوائها على روابط قطبية ) .
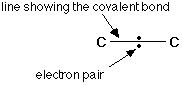
الرابطة التساهمية : عبارة عن زوج من الالكترونات يربط بين ذرتين تكون نتيجة مساهمة كلِ من الذرتين بالكترون واحد من مستوى التكافؤ .
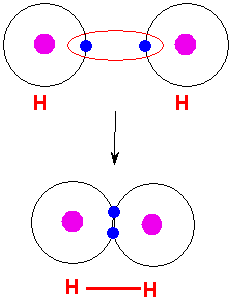
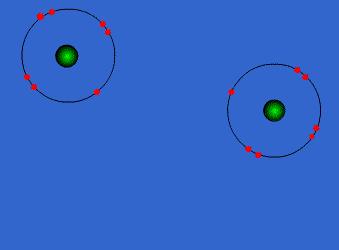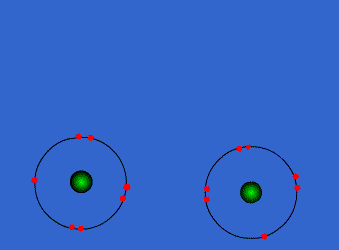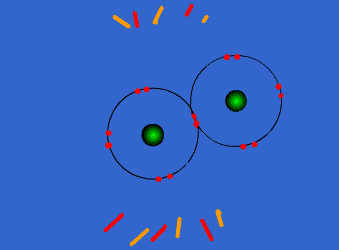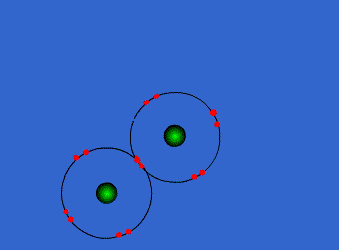
ويمكن أن يكون بين ذرتين رابطة تساهمية واحدة أو اثنتان أو ثلاث روابط .


وتتكون الرابطة التساهمية عادةً بين ذرات العناصر اللا فلزية ( متشابهه أو
غير متشابهة ) كما أن العناصر العليا في المجموعة الرابعة ( وأهمها
عنصرالكربون ) تميل دائماً إلى تكوين روابط تساهمية ، وقد ترتبط بعض
الفلزات ( كالبريليوم ) بروابط تساهمية مع عناصر أخرى .
خواص المركبات التساهمية
في المركبات التساهمية ( بعكس المركبات الأيونية ) يمكن لنا أن نتحدث عن
جزيئات مستقلة فالمركبات التساهمية تتألف من جزيئات مستقلة ترتبط ببعضها
بروابط مختلفة ( فان درفال ، هيدروجينية ) متفاوتة في قوتها . لذلك توجد
المركبات التساهمية في جميع الحالات الثلاث حسب قوة هذه الروابط فهناك
مركبات تساهمية في حالة غازية ( روابط ضعيفة بين الجزيئات ) ومركبات
تساهمية في حالة سائلة وأيضاً يوجد مركبات تساهمية في حالة صلبة ( روابط
قوية بين الجزيئات ) ونفس الشيء بالنسبة لدرجات الانصهار والغليان
فالمركبات التساهمية تتفاوت في درجات غليانها وانصهارها حسب نوعية وقوة
الروابط بين الجزيئات .
أما بالنسبة للتوصيل الكهربي ففي الحالة النقية تكون المركبات التساهمية
غير موصلة للكهرباء في الغالب نظراً لكونها غير مشحونة أصلاً أو لكونها
متعادلة كهربياً في حالة وجود شحنات ، ولكن قد يكون للمشحونة منها ما يعرف
باسم العزم الكهربي وسيأتي .
وكذلك في مصاهيرها فمصهور المركب التساهمي الصلب ( كمصهور السكر مثلاً )
غير موصل للكهرباء ، أما بالنسبة للمحلول فقد يكون غير موصل كما في حالة
محلول السكر أو يكون موصلاً كما هو الحال في محلول كلوريد الهيدروجين ( حمض
الهيدروكلوريك ) ويرجع سبب التوصيل من عدمه في المحلول إلى تأين المركب
التساهمي ( تحوله إلى أيونات منفصلة بفعل المذيب ) أو عدم تأينه .
فالسكر لا يتأين عند إذابته في الماء وإنما تنفصل جزيئاته عن بعضها فقط
بينما يتأين كلوريد الهيدروجين إلى أيون الهيدروجين وأيون الكلور
وسائل تعليمية كيمياء chemistry وسائل تعليمية كيمياء chemistry
وسائل تعليمية كيمياء chemistry

إخواني وأخواتي السلام عليكم ورحمة الله وبركاته وأهلاً وسهلاً بكم مع :
درس الرابطة التساهمية

الأهداف التعليمية
يتوقع من الطالب في نهاية الدرس أن :
1- يعرّف الرابطة التساهمية .
2- يمثّل للرابطة التساهمية .
3- يذكر بعض العناصرالتي يمكن لها الارتباط بروابط تساهمية .
4- يشرح سبب وجود المركبات التساهمية في كل الحالات الثلاث للمادة .
5- يوضح سبب عدم توصيل المركبات التساهمية للتيار الكهربي في حالتها النقية وفي مصاهير الصلبة منها .
6- يحدّد متى يكون المحلول المائي للمركب التساهمي موصلاً للكهرباء .
7- يتعرّف تركيب لويس للجزيئات التساهمية .
8- يوضح تركيب لويس لجزيء تساهمي معطى .
9- يميّز بين الزوج الالكتروني الرابط والزوج غير الرابط .
10- يعرّف القاعدة الثمانية .
11- يمثّل لجزيئات تساهمية تشد في تركيبها عن القاعدة الثمانية .
12- يوضح سبب اتخاذ الجزيئات التساهمية لأشكال هندسية في الفراغ .
13- يذكر العامل الذي يحدّد الشكل الهندسي للجزيء التساهمي .
14- يذكر سبب اختلاف الزوايا بين الروابط في الشكل الهندسي الواحد .
15- يعرّف السالبية الكهربية للعناصر .
16- يوضّح طبيعة العلاقة بين جهد التأين والألفة الالكترونية للعناصر من جهة وبين سالبيتها الكهربية .
17- يكتب قيم السالبية الكهربية للعناصر التالية : الفلور ، الأكسجين ، الكلور ، النيتروجين ، الكربون ، الهيدروجين .
18- يشرح مفهوم القطبية في الجزيئات التساهمية .
19- يحدّد متى تكون الرابطة التساهمية قطبية ومتى تكون غير قطبية .
20- يميّز بين المركبات القطبية وغير القطبية .
21- يعرّف العزم الكهربائي .
22- يعلّل سبب عدم قطبية بعض المركبات التساهمية بالرغم من اختلاف عناصرها في السالبية الكهربية ( احتوائها على روابط قطبية ) .
الرابطة التساهمية : عبارة عن زوج من الالكترونات يربط بين ذرتين تكون نتيجة مساهمة كلِ من الذرتين بالكترون واحد من مستوى التكافؤ .



ويمكن أن يكون بين ذرتين رابطة تساهمية واحدة أو اثنتان أو ثلاث روابط .


وتتكون الرابطة التساهمية عادةً بين ذرات العناصر اللا فلزية ( متشابهه أو
غير متشابهة ) كما أن العناصر العليا في المجموعة الرابعة ( وأهمها
عنصرالكربون ) تميل دائماً إلى تكوين روابط تساهمية ، وقد ترتبط بعض
الفلزات ( كالبريليوم ) بروابط تساهمية مع عناصر أخرى .
خواص المركبات التساهمية
في المركبات التساهمية ( بعكس المركبات الأيونية ) يمكن لنا أن نتحدث عن
جزيئات مستقلة فالمركبات التساهمية تتألف من جزيئات مستقلة ترتبط ببعضها
بروابط مختلفة ( فان درفال ، هيدروجينية ) متفاوتة في قوتها . لذلك توجد
المركبات التساهمية في جميع الحالات الثلاث حسب قوة هذه الروابط فهناك
مركبات تساهمية في حالة غازية ( روابط ضعيفة بين الجزيئات ) ومركبات
تساهمية في حالة سائلة وأيضاً يوجد مركبات تساهمية في حالة صلبة ( روابط
قوية بين الجزيئات ) ونفس الشيء بالنسبة لدرجات الانصهار والغليان
فالمركبات التساهمية تتفاوت في درجات غليانها وانصهارها حسب نوعية وقوة
الروابط بين الجزيئات .
أما بالنسبة للتوصيل الكهربي ففي الحالة النقية تكون المركبات التساهمية
غير موصلة للكهرباء في الغالب نظراً لكونها غير مشحونة أصلاً أو لكونها
متعادلة كهربياً في حالة وجود شحنات ، ولكن قد يكون للمشحونة منها ما يعرف
باسم العزم الكهربي وسيأتي .
وكذلك في مصاهيرها فمصهور المركب التساهمي الصلب ( كمصهور السكر مثلاً )
غير موصل للكهرباء ، أما بالنسبة للمحلول فقد يكون غير موصل كما في حالة
محلول السكر أو يكون موصلاً كما هو الحال في محلول كلوريد الهيدروجين ( حمض
الهيدروكلوريك ) ويرجع سبب التوصيل من عدمه في المحلول إلى تأين المركب
التساهمي ( تحوله إلى أيونات منفصلة بفعل المذيب ) أو عدم تأينه .
فالسكر لا يتأين عند إذابته في الماء وإنما تنفصل جزيئاته عن بعضها فقط
بينما يتأين كلوريد الهيدروجين إلى أيون الهيدروجين وأيون الكلور


 الموقع
الموقع العمل/الترفيه
العمل/الترفيه


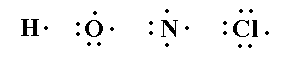
















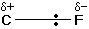

» موسوعة شيلان كروشية بالباترون
» الحروف العربية ( الأبجدية ) مع الصور للتلوين
» أكثر من 30 رسمة للتلوين لغرس السلوكيات الإسلامية
» نمي مهارات طفلك الحسابية واليدوية مع لعبة وصل الأرقام واكتشف الصورة
» كتيب اعمال يدويةو فنية للاطفال
» موسوعة كوفيات الكروشية (crochet scarfs ) بالباترون
» لعبة وصل الأرقام واكتشف الصورة لتنمية ذكاء الاطفال
» جاكيت طويل شتوي بالكروشية مع الباترون
» علب مناديل بالخرز 3 موديلات بالباترون
» توب كله انوووووووووووثه من عمل ايديك
» 6 مفارش كروشية مستديرة وخطيرة بالباترون
» من بنطلون قديم وتيشرت اعملي توب راااااائع كله انوووووثه
» 4 وحدات يعملوا جيليه رووووووعة بالكروشية مع الباترون
» جيليه يضفي على ملابسك شياااااااااكة كروشية بالباترون
» باليرو ررررررررررررررقة كروشية بالباترون
» الأرقام الانجليزية من ( 1 - 10 ) للتلوين
» 4 مفارش ايتامين لها حواف كروشية خطيرررررررة بالباترون
» موسوعة وحدات كروشية على شكل أدوات مطبخ بالباترون
» شنطة حلوووووة من تيشيرت قديم
» تفنني بخياطه فستان ناعم لنفسك بدون باترون والطريقة بالفيديو
» خياطة تنورة قصيرة بكرانيش بدون باترون آخر انوووووثة ( فيديو )
» من بوكسر زوجك اعملي تنورة امووووووووورة
» التيشيرت الساحر فصلي منه 10 موديلات منتهى البساطة
» لون وتعلم المحافظة على آداب الطعام